Nowoczesne PRP: „Kliniczne PRP”
W ciągu ostatnich 10 lat schemat leczenia PRP uległ dużym zmianom.Dzięki badaniom eksperymentalnym i klinicznym lepiej rozumiemy fizjologię płytek krwi i innych komórek.Ponadto kilka wysokiej jakości ocen systematycznych, metaanaliz i randomizowanych badań kontrolowanych wykazało skuteczność biotechnologii PRP w wielu dziedzinach medycyny, w tym w dermatologii, kardiochirurgii, chirurgii plastycznej, chirurgii ortopedycznej, leczeniu bólu, chorobach kręgosłupa i medycynie sportowej .
Obecną cechą PRP jest bezwzględne stężenie płytek krwi, które zmienia się od początkowej definicji PRP (w tym stężenia płytek krwi wyższe niż wartość wyjściowa) do wartości większej niż 1 × 10 6/µl lub około 5-krotności minimalnego stężenia płytek krwi w płytkach krwi z linia bazowa.W obszernym przeglądzie Fadadu i in.Oceniono 33 systemy i protokoły PRP.Liczba płytek krwi w końcowym preparacie PRP wytwarzanym przez niektóre z tych systemów jest niższa niż w pełnej krwi.Poinformowali, że w przypadku zestawu do pojedynczego wirowania (Selphyl®) współczynnik płytek krwi w PRP wzrósł do zaledwie 0,52.Natomiast podwójna rotacja EmCyte Genesis PurePRPII ® Stężenie płytek krwi wytwarzane przez urządzenie jest najwyższe (1,6 × 10 6 /µL).
Oczywiście metody in vitro i metody na zwierzętach nie są idealnym środowiskiem badawczym do skutecznego wprowadzenia ich do praktyki klinicznej.Podobnie badanie porównawcze urządzeń nie potwierdza tej decyzji, ponieważ pokazuje, że stężenie płytek krwi pomiędzy urządzeniami PRP jest bardzo różne.Na szczęście dzięki technologii i analizie opartej na proteomice możemy lepiej zrozumieć funkcje komórkowe PRP, które wpływają na wyniki leczenia.Przed osiągnięciem konsensusu w sprawie standaryzowanych preparatów i preparatów PRP, PRP powinno opierać się na klinicznych preparatach PRP, aby promować istotne mechanizmy naprawy tkanek i postępujące wyniki kliniczne.
Kliniczna formuła PRP
Obecnie skuteczny kliniczny PRP (C-PRP) scharakteryzowano jako złożoną kompozycję autologicznych składników wielokomórkowych w małej objętości osocza uzyskanego z części krwi obwodowej po odwirowaniu.Po odwirowaniu PRP i jego składniki komórkowe niebędące płytkami krwi można odzyskać z urządzenia do zatężania w zależności od gęstości komórek (z których gęstość płytek jest najniższa).
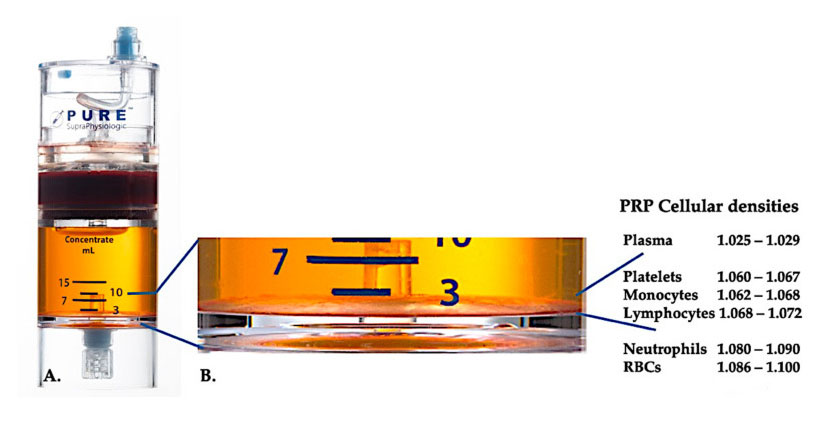
Stosowanie sprzętu do separacji gęstości komórek PurePRP-SP® (EmCyte Corporation, Fort Myers, Floryda, USA) zastosowano do pełnej krwi po dwóch procedurach wirowania.Po pierwszym procesie wirowania składnik pełnej krwi rozdzielono na dwie podstawowe warstwy, zawiesinę osocza płytek krwi (ubogiego) i warstwę czerwonych krwinek.W A drugi etap wirowania został zakończony.Rzeczywistą objętość PRP można pobrać do zastosowania u pacjenta.Powiększenie w B pokazuje, że na dnie urządzenia znajduje się zorganizowana, wieloskładnikowa brązowa warstwa sedymentacyjna erytrocytów (przedstawiona przez niebieską linię), która zawiera wysokie stężenia płytek krwi, monocytów i limfocytów, w oparciu o gradient gęstości.W tym przykładzie, zgodnie z protokołem przygotowania C-PRP ze słabymi neutrofilami, ekstrahowany zostanie minimalny odsetek neutrofili (<0,3%) i erytrocytów (<0,1%).
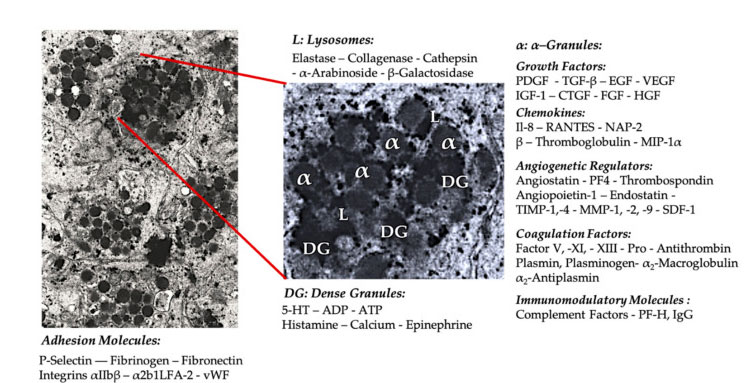
Granulki płytek krwi
We wczesnych klinicznych zastosowaniach PRP, granulki α są najczęściej cytowaną strukturą wewnętrzną płytek krwi, ponieważ zawierają czynniki krzepnięcia, dużą liczbę PDGF i regulatory angiogenne, ale mają niewielką funkcję trombogenną.Inne czynniki obejmują mniej znane składniki chemokin i cytokin, takie jak czynnik płytkowy 4 (PF4), zasadowe białko przedpłytkowe, selektyna P (aktywator integryny) i chemokina RANTES (regulowana przez aktywację, wyrażająca normalne limfocyty T i prawdopodobnie wydzielanie).Ogólną funkcją tych specyficznych składników ziarnistości płytek krwi jest rekrutacja i aktywacja innych komórek odpornościowych lub wywołanie zapalenia komórek śródbłonka.
Gęste, ziarniste składniki, takie jak ADP, serotonina, polifosforan, histamina i adrenalina, są bardziej pośrednio stosowane jako regulatory aktywacji płytek krwi i zakrzepicy.Co najważniejsze, wiele z tych elementów pełni funkcję modyfikacji komórek odpornościowych.ADP płytek krwi jest rozpoznawany przez receptor P2Y12ADP na komórkach dendrytycznych (DC), zwiększając w ten sposób endocytozę antygenu.DC (komórka prezentująca antygen) jest bardzo ważna dla inicjowania odpowiedzi immunologicznej limfocytów T i kontrolowania ochronnej odpowiedzi immunologicznej, która łączy wrodzony układ odpornościowy z nabytym układem odpornościowym.Ponadto adenozynotrifosforan płytek krwi (ATP) wysyła sygnały przez receptor komórek T P2X7, co prowadzi do zwiększonego różnicowania pomocniczych komórek T CD4 w prozapalne komórki T pomocnicze 17 (Th17).Inne składniki gęstych ziarnistości płytek krwi (takie jak glutaminian i serotonina) indukują odpowiednio migrację limfocytów T i zwiększają różnicowanie monocytów do DC.W PRP te immunomodulatory pochodzące z gęstych cząstek są wysoce wzbogacone i pełnią istotne funkcje odpornościowe.
Liczba bezpośrednich i pośrednich potencjalnych interakcji między płytkami krwi a innymi komórkami (receptorami) jest obszerna.Dlatego zastosowanie PRP w lokalnym środowisku tkanki patologicznej może wywołać różnorodne skutki zapalne.
Stężenie płytek krwi
Aby uzyskać korzystne efekty terapeutyczne, C-PRP powinien zawierać dawki kliniczne skoncentrowanych płytek krwi.Płytki krwi w C-PRP powinny stymulować proliferację komórek, syntezę czynników mezenchymalnych i neurotroficznych, sprzyjać migracji komórek chemotaktycznych i stymulować aktywność immunoregulacyjną, jak pokazano na rycinie.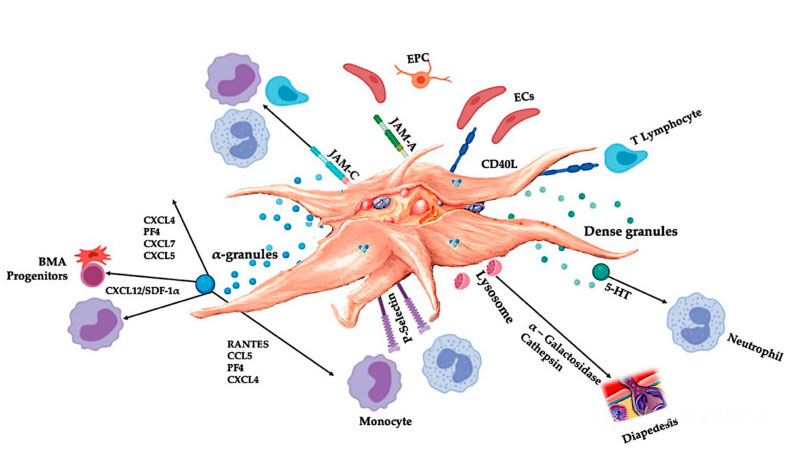
Aktywowane płytki krwi, uwalnianie PGF i cząsteczki adhezyjne pośredniczą w różnorodnych interakcjach komórkowych: chemotaksji, adhezji komórek, migracji i różnicowaniu komórek oraz regulują czynności regulujące układ odpornościowy.Te interakcje między komórkami płytek krwi przyczyniają się do angiogenezy i aktywności zapalnej, a ostatecznie stymulują proces naprawy tkanek.Skróty: BMA: aspirat szpiku kostnego, EPC: śródbłonkowe komórki progenitorowe, EC: komórki śródbłonka, 5-HT: 5-hydroksytryptamina, RANTES: aktywowana regulacja ekspresji normalnych komórek T i przypuszczalnego wydzielania, JAM: typ cząsteczki adhezji złącza, CD40L: klaster 40, SDF-1 α: Czynnik 1 pochodzący z komórek zrębowych α, CXCL: ligand chemokiny (motyw CXC), PF4: czynnik płytkowy 4. Na podstawie Everts et al.
Marks był pierwszą osobą, która udowodniła, że następuje lepsze gojenie kości i tkanek miękkich, a minimalna liczba płytek krwi wynosi 1 × 10 6 /µl. Wyniki te zostały potwierdzone w badaniu zrostu lędźwiowego przez otwór międzykręgowy, gdy dawka płytek krwi była większa niż 1,3 × Przy 106 płytek krwi/µl badanie to wykazało większą fuzję.Ponadto Giusti i in.Ujawniono 1,5 × Mechanizm naprawy tkanki przy dawce 109 wymaga płytek krwi/ml do indukcji funkcjonalnej angiogenezy poprzez aktywność komórek śródbłonka.W tym drugim badaniu wyższe stężenia zmniejszały potencjał angiogenezy płytek krwi w pęcherzykach i wokół nich.Ponadto wcześniejsze dane wskazywały, że dawka PRP również miała wpływ na wyniki leczenia.Dlatego też, aby znacząco indukować reakcję angiogenezy i stymulować proliferację i migrację komórek, C-PRP powinien zawierać co najmniej 7,5 w 5 ml butelce do leczenia PRP × 10 9, które może dostarczyć płytki krwi.
Oprócz zależności od dawki, wpływ PRP na aktywność komórek wydaje się być w dużym stopniu zależny od czasu.Sophie i in.Wyniki te sugerują, że krótkotrwała ekspozycja na lizaty ludzkich płytek krwi może stymulować proliferację i chemotaksję komórek kostnych.Wręcz przeciwnie, długotrwałe narażenie na PRP doprowadzi do obniżenia poziomu fosfatazy alkalicznej i tworzenia się minerałów.
czerwona krwinka
Czerwone krwinki odpowiadają za transport tlenu do tkanek i przenoszenie dwutlenku węgla z tkanek do płuc.Nie mają jądra i składają się z cząsteczek hemu, które wiążą się z białkami.Składniki żelaza i hemu w czerwonych krwinkach sprzyjają połączeniu tlenu i dwutlenku węgla.Ogólnie rzecz biorąc, cykl życia czerwonych krwinek wynosi około 120 dni.Są usuwane z krążenia przez makrofagi w procesie zwanym starzeniem się czerwonych krwinek.Czerwone krwinki w próbkach PRP mogą zostać uszkodzone w warunkach ścinania (na przykład podczas operacji polegającej na krwawieniu z krwi pełnej, procesie immunologicznym, stresie oksydacyjnym lub nieodpowiednim schemacie stężenia PRP).Dlatego błona komórkowa RBC rozkłada się i uwalnia toksyczną hemoglobinę (Hb), mierzoną za pomocą wolnej hemoglobiny w osoczu (PFH), hemu i żelaza.].PFH i produkty jego rozkładu (hem i żelazo) łącznie prowadzą do szkodliwego i cytotoksycznego działania na tkanki, prowadząc do stresu oksydacyjnego, utraty tlenku azotu, aktywacji szlaków zapalnych i immunosupresji.Efekty te ostatecznie doprowadzą do zaburzeń mikrokrążenia, miejscowego zwężenia naczyń i uszkodzenia naczyń, a także poważnego uszkodzenia tkanek.
Najważniejsze jest to, że podanie do tkanki czerwonych krwinek zawierających C-PRP powoduje miejscową reakcję zwaną eryptozą, która powoduje uwolnienie skutecznego inhibitora migracji cytokin i makrofagów.Cytokina ta hamuje migrację monocytów i makrofagów.Wywiera silne sygnały prozapalne do otaczających tkanek, hamuje migrację komórek macierzystych i proliferację fibroblastów, prowadzi do znacznej lokalnej dysfunkcji komórek.Dlatego ważne jest ograniczenie zanieczyszczenia krwinek czerwonych w preparatach PRP.Ponadto nigdy nie ustalono roli czerwonych krwinek w regeneracji tkanek.Odpowiedni proces wirowania i przygotowania C-PRP zwykle zmniejsza lub nawet eliminuje obecność czerwonych krwinek, unikając w ten sposób niekorzystnych konsekwencji hemolizy i czerwienicy.
Leukocyty w C-PRP
Obecność białych krwinek w preparatach PRP zależy od sprzętu do zabiegu i schematu przygotowania.W sprzęcie PRP opartym na osoczu białe krwinki są całkowicie eliminowane;Jednakże białe krwinki były znacząco stężone w preparacie PRP w brązowej warstwie sedymentacyjnej erytrocytów.Ze względu na mechanizmy immunologiczne i obronne gospodarza, białe krwinki w dużym stopniu wpływają na biologię wewnętrzną ostrych i przewlekłych chorób tkanek.Funkcje te zostaną omówione szczegółowo poniżej.Dlatego obecność specyficznych leukocytów w C-PRP może powodować znaczące skutki komórkowe i tkankowe.Mówiąc dokładniej, różne systemy sedymentacji erytrocytów PRP z brązowo-żółtą warstwą wykorzystują różne schematy przygotowania, tworząc w ten sposób różną proporcję neutrofili, limfocytów i monocytów w PRP.W preparatach PRP nie można oznaczać zawartości eozynofili i bazofilów, ponieważ ich błony komórkowe są zbyt delikatne, aby wytrzymać działanie sił odśrodkowych.
Neutrofile
Neutrofile są niezbędnymi leukocytami na wielu szlakach gojenia.Szlaki te łączą się z białkami przeciwdrobnoustrojowymi obecnymi w płytkach krwi, tworząc gęstą barierę przed inwazyjnymi patogenami.Istnienie neutrofili określa się zgodnie z celem leczenia C-PRP.Zwiększony poziom zapalenia tkanek może być wymagany w przypadku bioterapii PRP w leczeniu przewlekłych ran lub w zastosowaniach mających na celu wzrost lub gojenie kości.Co ważne, w kilku modelach odkryto dodatkowe funkcje neutrofili, podkreślając ich rolę w angiogenezie i naprawie tkanek.Neutrofile mogą jednak również powodować szkodliwe skutki, dlatego nie nadają się do niektórych zastosowań.Zhou i Wang wykazali, że stosowanie PRP bogatego w neutrofile może prowadzić do zwiększenia stosunku kolagenu typu III do kolagenu typu I, zaostrzając w ten sposób zwłóknienie i zmniejszając siłę ścięgien.Inne szkodliwe właściwości, w których pośredniczą neutrofile, to uwalnianie cytokin zapalnych i metaloproteinaz macierzy (MMP), które po zastosowaniu na tkanki mogą sprzyjać zapaleniu i katabolizmowi.
Leukomonocyt
W C-PRP jednojądrzaste limfocyty T i B są bardziej stężone niż jakiekolwiek inne białe krwinki.Są one ściśle powiązane z cytotoksyczną odpornością nabytą za pośrednictwem komórek.Limfocyty mogą wyzwalać reakcje komórkowe w celu zwalczania infekcji i dostosowywania się do najeźdźców.Ponadto cytokiny pochodzące z limfocytów T (interferon-γ [IFN-γ] i interleukina-4 (IL-4) nasilają polaryzację makrofagów. Verassar i wsp. Udowodniono, że konwencjonalne limfocyty T mogą pośrednio sprzyjać gojeniu tkanek model mysi poprzez regulację różnicowania monocytów i makrofagów.
Monocyt – multipotencjalna komórka naprawcza
W zależności od użytego urządzenia do przygotowania PRP, monocyty mogą wystawać lub nie występować w butelce do leczenia PRP.Niestety, ich działanie i zdolność regeneracyjna są rzadko omawiane w literaturze.Dlatego też w sposobie przygotowania lub recepturze końcowej niewiele uwagi poświęca się monocytom.Grupa monocytów jest heterogenna, pochodzi z komórek progenitorowych w szpiku kostnym i jest transportowana do tkanek obwodowych szlakiem krwiotwórczych komórek macierzystych zgodnie ze stymulacją mikrośrodowiska.Podczas homeostazy i stanu zapalnego krążące monocyty opuszczają strumień krwi i są rekrutowane do uszkodzonych lub zdegradowanych tkanek.Mogą działać jako makrofagi (M Φ) Komórki efektorowe lub komórki progenitorowe.Monocyty, makrofagi i komórki dendrytyczne reprezentują jednojądrzasty układ fagocytarny (MPS). Typową cechą MPS jest plastyczność wzoru ekspresji genów i funkcjonalne nakładanie się tych typów komórek.W zdegenerowanych tkankach rezydujące makrofagi, lokalnie działające czynniki wzrostu, cytokiny prozapalne, komórki apoptotyczne lub martwicze oraz produkty drobnoustrojów inicjują różnicowanie monocytów w grupy komórek MPS.Załóżmy, że gdy C-PRP zawierający wysokowydajne monocyty zostanie wstrzyknięty do lokalnego mikrośrodowiska choroby, monocyty prawdopodobnie różnicują się w M Φ, powodując poważne zmiany komórkowe.
Od monocytu do M Φ W procesie transformacji specyficzny M Φ Fenotyp.W ciągu ostatnich dziesięciu lat opracowano model integrujący M Φ Złożony mechanizm aktywacji opisano jako polaryzację dwóch przeciwstawnych stanów: M Φ Fenotyp 1 (M Φ 1, aktywacja klasyczna) i M Φ Fenotyp 2 (M Φ 2, aktywacja alternatywna).M Φ 1 charakteryzuje się wydzielaniem cytokin zapalnych (IFN-γ) i tlenkiem azotu, co powoduje skuteczny mechanizm zabijania patogenów.M Φ Fenotyp wytwarza także czynnik wzrostu śródbłonka naczyniowego (VEGF) i czynnik wzrostu fibroblastów (FGF).M Φ Fenotyp składa się z komórek przeciwzapalnych o wysokiej fagocytozie.M Φ 2 Wytwarzają składniki macierzy zewnątrzkomórkowej, angiogenezę i chemokiny oraz interleukinę 10 (IL-10).Oprócz obrony przed patogenami, M Φ Może również zmniejszać stany zapalne i wspomagać naprawę tkanek.Warto zauważyć, że M Φ 2 zostało podzielone na M in vitro Φ 2a, M Φ 2b i M Φ 2. Zależy to od bodźca.Tłumaczenie tych podtypów in vivo jest trudne, ponieważ tkanka może zawierać mieszane grupy MΦ.Co ciekawe, w oparciu o lokalne sygnały środowiskowe i poziomy IL-4, prozapalne M Φ 1 można przekształcić w celu wspomagania naprawy M Φ 2. Na podstawie tych danych rozsądne jest założenie, że istnieją wysokie stężenia monocytów i preparatów M Φ C-PRP mogą przyczyniać się do lepszej naprawy tkanek, ponieważ mają przeciwzapalne właściwości naprawy tkanek i przekazywania sygnału komórkowego.
Niejasna definicja frakcji białych krwinek w PRP
Obecność białych krwinek w butelkach do przygotowania PRP zależy od urządzenia do przygotowywania PRP i może różnić się znacząco.Istnieje wiele sporów dotyczących istnienia leukocytów i ich udziału w różnych produktach sub-PRP (takich jak PRGF, P-PRP, LP-PRP, LR-PRP, P-PRF i L-PRF). W niedawnym przeglądzie sześć randomizowanych kontrolowane badania (poziom dowodów 1) i trzy prospektywne badania porównawcze (poziom dowodów 2) objęły 1055 pacjentów, co wskazuje, że LR-PRP i LP-PRP charakteryzują się podobnym bezpieczeństwem.Autor doszedł do wniosku, że działanie niepożądane PRP może nie być bezpośrednio związane ze stężeniem białych krwinek.W innym badaniu LR-PRP nie zmienił interleukiny zapalnej (IL-1) w chorobie zwyrodnieniowej stawu kolanowego β, IL-6, IL-8 i IL-17).Wyniki te potwierdzają pogląd, że rola leukocytów w aktywności biologicznej PRP in vivo może wynikać z przesłuchu między płytkami krwi i leukocytami.Ta interakcja może sprzyjać biosyntezie innych czynników (takich jak lipoksygen), co może równoważyć lub sprzyjać regresji stanu zapalnego.Po początkowym uwolnieniu cząsteczek zapalnych (kwasu arachidonowego, leukotrienu i prostaglandyny), z aktywowanych płytek krwi uwalniany jest lipoksygen A4, aby zapobiec aktywacji neutrofili.To właśnie w tym środowisku fenotyp M Φ z M Φ 1 przechodzi w M Φ 2. Ponadto istnieje coraz więcej dowodów na to, że krążące komórki jednojądrzaste mogą różnicować się w różne typy komórek niefagocytarnych ze względu na ich pluripotencję.
Rodzaj PRP będzie miał wpływ na hodowlę MSC.W porównaniu z czystymi próbkami PRP lub PPP, LR-PRP może indukować znacznie większą proliferację MSC pochodzących ze szpiku kostnego (BMMSC), z szybszym uwalnianiem i lepszą aktywnością biologiczną PGF.Wszystkie te cechy sprzyjają dodaniu monocytów do butelki z kuracją PRP i rozpoznaniu ich zdolności immunomodulacyjnych i potencjału różnicowania.
Wrodzona i adaptacyjna regulacja immunologiczna PRP
Najbardziej znaną fizjologiczną funkcją płytek krwi jest kontrolowanie krwawienia.Gromadzą się w miejscu uszkodzenia tkanki i uszkodzonych naczyniach krwionośnych.Zdarzenia te są spowodowane ekspresją integryn i selektyn, które stymulują adhezję i agregację płytek krwi.Uszkodzony śródbłonek dodatkowo pogarsza ten proces, a odsłonięty kolagen i inne białka macierzy podśródbłonkowej sprzyjają głębokiej aktywacji płytek krwi.Wykazano w tych przypadkach istotną rolę interakcji pomiędzy czynnikiem von Willebranda (vWF) a glikoproteiną (GP), zwłaszcza GP-Ib.Po aktywacji płytek krwi, płytki α-, gęste, lizosomy i granulki T regulują egzocytozę i uwalniają swoją zawartość do środowiska zewnątrzkomórkowego.
Cząsteczka adhezyjna płytek krwi
Aby lepiej zrozumieć rolę PRP w tkankach zapalnych i płytkach krwi w odpowiedzi immunologicznej, powinniśmy zrozumieć, w jaki sposób różne receptory powierzchniowe płytek krwi (integryny) i cząsteczki adhezyjne na złączach (JAM) oraz interakcje komórkowe mogą inicjować krytyczne procesy odporności wrodzonej i nabytej.
Integryny to cząsteczki adhezyjne do powierzchni komórek, występujące w różnych typach komórek i ulegające ekspresji w dużych ilościach na płytkach krwi.Integryny obejmują a5b1, a6b1, a2b1 LFA-2, (GPIa/IIa) i aIIbb3 (GPIIb/IIIa).Zwykle istnieją w stanie statycznym i o niskim powinowactwie.Po aktywacji przechodzą w stan wysokiego powinowactwa wiązania liganda.Integryny pełnią różne funkcje na płytkach krwi i uczestniczą w interakcji płytek krwi z kilkoma typami białych krwinek, komórkami śródbłonka i macierzą zewnątrzkomórkową.Ponadto kompleks GP-Ib-V-IX ulega ekspresji na błonie płytek krwi i jest głównym receptorem wiążącym się z von vWF.Ta interakcja pośredniczy w początkowym kontakcie pomiędzy płytkami krwi a odsłoniętymi strukturami podśródbłonkowymi.Integryna płytkowa i kompleks GP są związane z różnymi procesami zapalnymi i odgrywają ważną rolę w tworzeniu kompleksu płytki krwi i leukocyty.W szczególności integryna aIIbb3 jest niezbędna do utworzenia stabilnego kompleksu poprzez połączenie fibrynogenu z receptorem antygenu makrofaga 1 (Mac-1) na neutrofilach.
Płytki krwi, neutrofile i komórki śródbłonka naczyń wykazują ekspresję specyficznych cząsteczek adhezyjnych, zwanych selektyną.W stanach zapalnych płytki krwi wykazują ekspresję P-selektyny i L-selektyny neutrofili.Po aktywacji płytek krwi selektyna P może wiązać się z ligandem PSGL-1 występującym na neutrofilach i monocytach.Ponadto wiązanie PSGL-1 inicjuje wewnątrzkomórkową reakcję kaskadową sygnału, która aktywuje neutrofile poprzez integrynę neutrofili Mac-1 i antygen 1 związany z funkcją limfocytów (LFA-1).Aktywowany Mac-1 wiąże się z GPIb lub GPIIb/IIIa na płytkach krwi poprzez fibrynogen, stabilizując w ten sposób interakcję pomiędzy neutrofilami i płytkami krwi.Ponadto aktywowany LFA-1 może łączyć się z cząsteczką adhezji międzykomórkowej płytek krwi 2 w celu dalszej stabilizacji kompleksu neutrofile-płytki krwi, aby promować długoterminową adhezję z komórkami.
Płytki krwi i leukocyty odgrywają kluczową rolę we wrodzonej i nabytej odpowiedzi immunologicznej
Organizm potrafi rozpoznać ciała obce i uszkodzone tkanki w chorobach ostrych lub przewlekłych, aby zapoczątkować reakcję kaskadową gojenia się ran i szlak zapalny.Wrodzony i nabyty układ odpornościowy chroni gospodarza przed infekcją, a białe krwinki odgrywają ważną rolę w nakładaniu się tych dwóch systemów.W szczególności monocyty, makrofagi, neutrofile i komórki NK odgrywają kluczową rolę w układzie wrodzonym, podczas gdy limfocyty i ich podzbiory odgrywają podobną rolę w nabytym układzie odpornościowym.
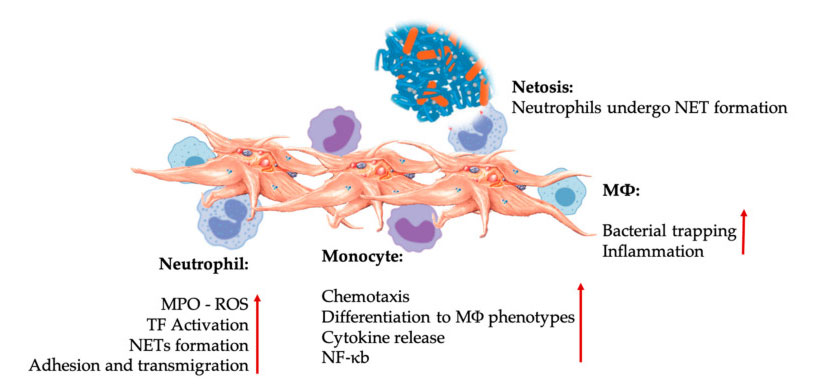
Interakcje płytek krwi i leukocytów we wrodzonych interakcjach komórek odpornościowych.Płytki krwi oddziałują z neutrofilami i monocytami, a wreszcie z M Φ Oddziałują, dostosowują i zwiększają ich funkcje efektorowe.Te interakcje płytki krwi i leukocyty prowadzą do stanu zapalnego poprzez różne mechanizmy, w tym NETosis.Skróty: MPO: mieloperoksydaza, ROS: reaktywne formy tlenu, TF: czynnik tkankowy, NET: zewnątrzkomórkowa pułapka neutrofili, NF-κ B: czynnik jądrowy kappa B, M Φ: Makrofagi.
Wrodzony układ odpornościowy
Rolą wrodzonego układu odpornościowego jest niespecyficzna identyfikacja inwazyjnych mikroorganizmów lub fragmentów tkanek i stymulowanie ich usuwania.Kiedy pewne struktury molekularne zwane receptorami rozpoznawania wzorców ekspresji powierzchniowej (PRR) połączą się z wzorcami molekularnymi związanymi z patogenami i wzorami molekularnymi związanymi z uszkodzeniami, aktywowany zostanie wrodzony układ odpornościowy.Istnieje wiele rodzajów PRR, w tym receptor Toll-podobny (TLR) i receptor podobny do RIG-1 (RLR).Receptory te mogą aktywować główny czynnik transkrypcyjny kappa B (NF-κ B). Reguluje on także wiele aspektów wrodzonej i nabytej odpowiedzi immunologicznej.Co ciekawe, płytki krwi wykazują również ekspresję różnych cząsteczek receptorów immunoregulacyjnych na swojej powierzchni i w cytoplazmie, takich jak selektyna P, ligand białka transbłonowego CD40 (CD40L), cytokiny (takie jak IL-1 β, TGF- β) i TLR specyficzna dla płytek krwi. Dlatego płytki krwi mogą oddziaływać z różnymi komórkami odpornościowymi.
Interakcja płytek krwi i białych krwinek w odporności wrodzonej
Kiedy płytki krwi dostają się do przepływu krwi lub tkanki lub atakują je, są jedną z komórek, które jako pierwsze wykrywają uszkodzenie śródbłonka i patogeny bakteryjne.Agregację płytek krwi i promują uwalnianie agonistów płytek ADP, trombiny i vWF, co powoduje aktywację płytek krwi i ekspresję receptorów chemokin płytkowych C, CC, CXC i CX3C, powodując w ten sposób płytki krwi w zakażonym miejscu lub uszkodzenie.
Wrodzony układ odpornościowy jest genetycznie przystosowany do wykrywania najeźdźców, takich jak wirusy, bakterie, pasożyty i toksyny, lub rany i rany tkanek.Jest to system niespecyficzny, ponieważ każdy patogen zostanie zidentyfikowany jako obcy lub obcy i szybko zlokalizowany.Wrodzony układ odpornościowy opiera się na zestawie białek i fagocytów, które rozpoznają dobrze zachowane cechy patogenów i szybko aktywują odpowiedź immunologiczną, aby pomóc wyeliminować najeźdźców, nawet jeśli żywiciel nigdy wcześniej nie był narażony na kontakt z określonymi patogenami.
Neutrofile, monocyty i komórki dendrytyczne są najczęstszymi komórkami odporności wrodzonej we krwi.Ich rekrutacja jest konieczna do uzyskania odpowiedniej wczesnej odpowiedzi immunologicznej.Kiedy PRP stosuje się w medycynie regeneracyjnej, interakcja płytki krwi z białymi komórkami reguluje stan zapalny, gojenie się ran i naprawę tkanek.TLR-4 na płytkach krwi stymuluje interakcję płytki-neutrofile, która reguluje tzw. wybuch oksydacyjny leukocytów poprzez regulację uwalniania reaktywnych form tlenu (ROS) i mieloperoksydazy (MPO) z neutrofili.Ponadto interakcja między płytkami-neutrofilami i degranulacją neutrofili prowadzi do tworzenia zewnątrzkomórkowych pułapek neutrofili (NET).NET składają się z jądra neutrofili i innej zawartości wewnątrzkomórkowej neutrofili, która może wychwytywać bakterie i zabijać je poprzez NETosis.Tworzenie się NET jest zasadniczym mechanizmem zabijania neutrofili.
Po aktywacji płytek krwi monocyty mogą migrować do tkanek chorych i zwyrodnieniowych, gdzie podejmują działania adhezyjne i wydzielają cząsteczki zapalne, które mogą zmieniać właściwości chemotaksyjne i proteolityczne.Ponadto płytki krwi mogą indukować aktywację monocytów NF-κB w celu regulacji funkcji efektorowej monocytów, która jest kluczowym mediatorem odpowiedzi zapalnej oraz aktywacji i różnicowania komórek odpornościowych.Płytki krwi dodatkowo promują endogenny wybuch oksydacyjny monocytów, co sprzyja niszczeniu patogenów fagocytarnych.W uwalnianiu MPO pośredniczy bezpośrednie oddziaływanie pomiędzy płytką krwi i monocytem CD40L-MAC-1.Co ciekawe, gdy selektyna P aktywuje płytki krwi w ostrych i przewlekłych stanach zapalnych tkanki, chemokiny pochodzące z płytek krwi PF4, RANTES, IL-1 β i CXCL-12 mogą zapobiegać spontanicznej apoptozie monocytów, ale promują ich różnicowanie do makrofagów.
Adaptacyjny układ odpornościowy
Gdy nieswoisty wrodzony układ odpornościowy rozpozna uszkodzenie drobnoustrojów lub tkanek, kontrolę przejmuje swoisty nabyty układ odpornościowy.Systemy adaptacyjne obejmują limfocyty B wiążące antygen (komórki B) i konwencjonalne limfocyty T (Treg), które koordynują usuwanie patogenów.Limfocyty T można z grubsza podzielić na limfocyty T pomocnicze (komórki Th) i limfocyty T cytotoksyczne (komórki Tc, znane również jako komórki T zabójcze).Komórki Th dzielą się dalej na komórki Th1, Th2 i Th17, które pełnią kluczowe funkcje w zapaleniu.Komórki Th mogą wydzielać cytokiny prozapalne (np. IFN-γ, TNF-β) i kilka interleukin (np. IL-17). Są szczególnie skuteczne w zapobieganiu wewnątrzkomórkowym infekcjom wirusowym i bakteryjnym. Komórki Th stymulują proliferację i różnicowanie komórek zaangażowanych w odpowiedź immunologiczna Komórki Tc to komórki efektorowe, które mogą eliminować docelowe mikroorganizmy i komórki wewnątrzkomórkowe i zewnątrzkomórkowe.
Co ciekawe, komórki Th2 wytwarzają IL-4 i wpływają na fenotyp M Φ Polaryzacja, M Φ Regeneracja sterowana M Φ 2, natomiast IFN-γ M Φ Zmiana na fenotyp zapalny M Φ 1, który zależy od dawki i czasu działania cytokin.Po aktywacji IL-4, MΦ2 indukuje różnicowanie komórek Treg w komórki Th2, a następnie wytwarza dodatkową IL-4 (pętla dodatniego sprzężenia zwrotnego).Komórki Th przekształcają M Φ Fenotyp ukierunkowany jest na fenotyp regeneracyjny w odpowiedzi na czynniki biologiczne pochodzenia tkankowego.Mechanizm ten opiera się na dowodach, że komórki Th odgrywają znaczącą rolę w kontrolowaniu stanu zapalnego i naprawie tkanek.
Interakcja płytek krwi i białych krwinek w odporności nabytej
Nabywczy układ odpornościowy wykorzystuje receptory specyficzne dla antygenu, zapamiętuje napotkane wcześniej patogeny i niszczy je, gdy później napotka żywiciela.Jednakże te adaptacyjne odpowiedzi odpornościowe rozwijały się powoli.Konias i in.Pokazuje, że składnik płytkowy przyczynia się do postrzegania ryzyka i naprawy tkanek, a interakcja między płytkami krwi i leukocytami sprzyja aktywacji nabytej odpowiedzi immunologicznej.
Podczas adaptacyjnej odpowiedzi odpornościowej płytki krwi promują odpowiedź monocytów i makrofagów poprzez dojrzewanie komórek DC i NK, co prowadzi do specyficznych odpowiedzi komórek T i B.Dlatego składniki ziarnistości płytek krwi bezpośrednio wpływają na odporność nabytą poprzez ekspresję CD40L, cząsteczki niezbędnej do regulacji nabytej odpowiedzi odpornościowej.Płytki krwi poprzez CD40L nie tylko odgrywają rolę w prezentacji antygenu, ale także wpływają na reakcję limfocytów T.Liu i in.Stwierdzono, że płytki krwi regulują odpowiedź limfocytów T CD4 w złożony sposób.Ta zróżnicowana regulacja podzbiorów komórek T CD4 oznacza, że płytki krwi pobudzają komórki T CD4 do reagowania na bodźce zapalne, wytwarzając w ten sposób silne odpowiedzi prozapalne i przeciwzapalne.
Płytki krwi regulują także odpowiedź adaptacyjną za pośrednictwem limfocytów B na patogeny drobnoustrojowe.Powszechnie wiadomo, że CD40L na aktywowanych komórkach T CD4 będzie wyzwalać CD40 komórek B, zapewniając drugi sygnał wymagany do aktywacji limfocytów B zależnej od komórek T, późniejszej konwersji allotypu oraz różnicowania i proliferacji komórek B.Ogólnie rzecz biorąc, wyniki wyraźnie pokazują różne funkcje płytek krwi w odporności nabytej, wskazując, że płytki krwi łączą interakcję między komórkami T i komórkami B poprzez CD40-CD40L, wzmacniając w ten sposób zależną od komórek T odpowiedź komórek B.Ponadto płytki krwi są bogate w receptory na powierzchni komórki, które mogą promować aktywację płytek krwi i uwalniać dużą liczbę cząsteczek zapalnych i biologicznie aktywnych przechowywanych w różnych cząsteczkach płytek krwi, wpływając w ten sposób na wrodzoną i adaptacyjną odpowiedź immunologiczną.
Rozszerzona rola serotoniny pochodzącej z płytek krwi w PRP
Serotonina (5-hydroksytryptamina, 5-HT) odgrywa kluczową rolę w ośrodkowym układzie nerwowym (OUN), w tym w tolerancji bólu.Szacuje się, że większość ludzkiego 5-HT jest wytwarzana w przewodzie pokarmowym, a następnie poprzez krążenie krwi, gdzie jest wchłaniana przez płytki krwi poprzez transporter wychwytu zwrotnego serotoniny i magazynowana w gęstych cząsteczkach w wysokim stężeniu (65 mmol/l).5-HT jest dobrze znanym neuroprzekaźnikiem i hormonem, który pomaga regulować różne procesy neuropsychologiczne w OUN (centralny 5-HT).Jednakże większość 5-HT występuje poza OUN (obwodowy 5-HT) i bierze udział w regulacji ogólnoustrojowych i komórkowych funkcji biologicznych wielu narządów, w tym układu sercowo-naczyniowego, płuc, przewodu pokarmowego, układu moczowo-płciowego i płytek krwi.Metabolizm 5-HT jest zależny od stężenia w różnych typach komórek, w tym w adipocytach, komórkach nabłonkowych i białych krwinkach.Obwodowy 5-HT jest również silnym modulatorem immunologicznym, który może stymulować lub hamować stany zapalne i wpływać na różne komórki odpornościowe poprzez specyficzny receptor 5-HT (5HTR).
Parakrynny i autokrynny mechanizm HT
W aktywności 5-HT pośredniczy jego interakcja z 5HTR, które stanowią nadrodzinę składającą się z siedmiu członków (5-HT 1 – 7) i co najmniej 14 różnych podtypów receptorów, w tym niedawno odkrytego członka 5-HT 7, jego obwodowego i funkcję w leczeniu bólu.W procesie degranulacji płytek krwi aktywowane płytki wydzielają dużą ilość 5-HT pochodzącego z płytek krwi, który może sprzyjać skurczowi naczyń i stymulować aktywację sąsiadujących płytek krwi i limfocytów poprzez ekspresję 5-HTR na komórkach śródbłonka, komórkach mięśni gładkich i komórkach mięśni gładkich. komórki odpornościowe.Pacala i in.Badano mitotyczny wpływ 5-HT na komórki śródbłonka naczyń i określono potencjał promowania wzrostu uszkodzonych naczyń krwionośnych poprzez stymulację angiogenezy.Sposób regulacji tych procesów nie jest całkowicie jasny, ale może obejmować zróżnicowane dwukierunkowe szlaki sygnałowe w mikroukładzie tkankowym w celu regulacji funkcji komórek śródbłonka naczyń i komórek mięśni gładkich, fibroblastów i komórek odpornościowych poprzez specyficzne receptory 5-HT na tych komórkach .Opisano autokrynną funkcję 5-HT płytek krwi po aktywacji płytek krwi [REF].Uwalnianie 5-HT wzmaga aktywację płytek krwi i rekrutację krążących płytek krwi, co prowadzi do aktywacji reakcji kaskady sygnałowej i efektorów znajdujących się powyżej, wspierających reaktywność płytek.
Immunomodulacyjny efekt 5-HT
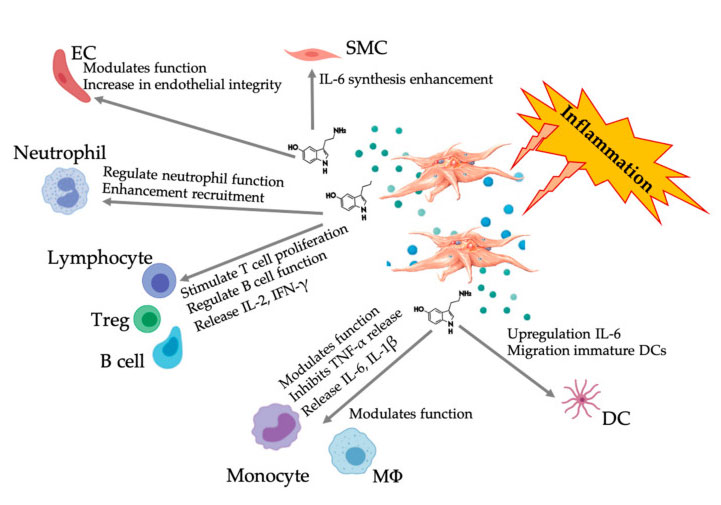
Coraz więcej dowodów wskazuje, że serotonina może odgrywać rolę w różnych 5HTR jako modulator odporności.Zgodnie z 5HTR wyrażanym w różnych leukocytach biorących udział w reakcji zapalnej, 5-HT pochodzenia płytkowego działa jako regulator odporności zarówno w wrodzonym, jak i nabytym układzie odpornościowym.5-HT może stymulować proliferację Treg i regulować funkcje limfocytów B, komórek NK i neutrofili poprzez rekrutację DC i monocytów do miejsca zapalenia.Ostatnie badania wykazały, że 5-HT pochodzenia płytkowego może regulować funkcję komórek odpornościowych w określonych warunkach.Dlatego przy użyciu C-PRP stężenie płytek krwi jest większe niż 1 × 10 6/µl, co może znacząco pomóc w transporcie stężenia 5-HT pochodzącego z dużych płytek krwi do tkanki.W mikrośrodowisku charakteryzującym się składnikami zapalnymi PRP może oddziaływać z kilkoma komórkami odpornościowymi, które odgrywają kluczową rolę w tych patologiach, co może mieć wpływ na wyniki kliniczne.
Figura przedstawiająca wieloaspektową odpowiedź 5-HT po aktywacji zapalnych płytek krwi PRP.Po aktywacji płytek krwi, płytki krwi uwalniają swoje granulki, w tym 5-HT w gęstych granulkach, co ma szeroki zakres zróżnicowanego działania na różne komórki odpornościowe, komórki śródbłonka i komórki mięśni gładkich.Skróty: SMC: komórki mięśni gładkich, EC: komórki śródbłonka, Treg: konwencjonalne limfocyty T, M Φ: makrofagi, DC: komórki dendrytyczne, IL: interleukina, IFN-γ: interferon γ. Zmodyfikowano i zaadaptowano na podstawie Everts et al.oraz Hull i in.
Przeciwbólowe działanie PRP
Aktywowane płytki krwi uwolnią wiele mediatorów prozapalnych i przeciwzapalnych, które mogą nie tylko powodować ból, ale także zmniejszać stan zapalny i ból.Po zastosowaniu, typowa dynamika płytek krwi PRP zmienia mikrośrodowisko przed naprawą i regeneracją tkanek poprzez różnorodne złożone szlaki związane z anabolizmem i katabolizmem, proliferacją, różnicowaniem i regulacją komórek macierzystych.Te cechy PRP prowadzą do zastosowania PRP w różnych klinicznych stanach patologicznych, zwykle związanych z bólem przewlekłym (takich jak urazy sportowe, choroby ortopedyczne, choroby kręgosłupa i złożone rany przewlekłe), chociaż dokładny mechanizm nie został w pełni poznany.
W 2008 roku Evertz i in.Jest to pierwsze randomizowane, kontrolowane badanie oceniające działanie przeciwbólowe preparatu PRP, który przygotowuje się z brązowej warstwy autologicznej sedymentacji erytrocytów i aktywuje autologiczną trombiną po operacji barku.Zauważyli znaczną redukcję wyników w wizualnej skali analogowej, stosowanie opioidowych leków przeciwbólowych i skuteczniejszą rehabilitację pooperacyjną.Warto zauważyć, że odzwierciedlają one działanie przeciwbólowe aktywowanych płytek krwi i spekulują na temat mechanizmu uwalniania 5-HT przez płytki krwi.Krótko mówiąc, płytki krwi są uśpione w świeżo przygotowanym PRP.Po bezpośredniej lub pośredniej aktywacji płytek krwi (czynnik tkankowy), płytki krwi zmieniają kształt i wytwarzają na tyle fałszywe, aby sprzyjać agregacji płytek krwi.Następnie uwalniają wewnątrzkomórkowe cząsteczki α- I gęste.Tkanka traktowana aktywowanym PRP zostanie zaatakowana przez PGF, cytokiny i inne lizosomy płytek krwi.Mówiąc dokładniej, gdy gęste cząstki uwolnią swoją zawartość, uwolnią dużą ilość 5-HT, który reguluje ból.W C-PRP stężenie płytek krwi jest 5 do 7 razy większe niż we krwi obwodowej.Dlatego uwalnianie 5-HT z płytek krwi jest astronomiczne.Co ciekawe, Sprott i in.W raporcie zaobserwowano, że po akupunkturze i moksoterapii nastąpiła znaczna ulga w bólu, znaczne zmniejszenie stężenia 5-HT pochodzącego z płytek krwi, a następnie zwiększenie poziomu 5-HT w osoczu.
W układzie obwodowym płytki krwi, komórki tuczne i komórki śródbłonka uwalniają endogenny 5-HT podczas uszkodzenia tkanki lub urazu chirurgicznego.Co ciekawe, w obszarze obwodowym wykryto różnorodne receptory 5-HT neuronów, co potwierdziło, że 5-HT może zakłócać transmisję nocyceptywną w obszarze obwodowym.Badania te pokazują, że 5-HT może wpływać na transmisję nocyceptywną tkanek obwodowych poprzez receptory 5-HT1, 5-HT2, 5-HT3, 5-HT4 i 5-HT7.
System 5-HT reprezentuje potężny system, który może zmniejszyć i zwiększyć stopień bólu po szkodliwej stymulacji.U pacjentów z bólem przewlekłym donoszono o centralnej i obwodowej regulacji sygnałów nocyceptywnych oraz zmianach w układzie 5-HT.W ostatnich latach wiele badań skupiło się na roli 5-HT i odpowiednich receptorów w przetwarzaniu i regulowaniu szkodliwych informacji, w wyniku czego powstały leki takie jak selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI).Lek ten hamuje wychwyt zwrotny serotoniny do neuronów presynaptycznych po uwolnieniu serotoniny.Wpływa na czas trwania i intensywność komunikacji serotoninowej i stanowi alternatywną metodę leczenia przewlekłego bólu.Konieczne są dalsze badania kliniczne, aby jasno zrozumieć molekularny mechanizm regulacji bólu 5-HT za pośrednictwem PRP w chorobach przewlekłych i zwyrodnieniowych.
Inne dane umożliwiające określenie potencjalnego działania przeciwbólowego PRP można uzyskać po badaniu na zwierzęcym modelu działania przeciwbólowego.Porównawcze wnioski statystyczne w tych modelach są trudne, ponieważ badania te zawierają zbyt wiele zmiennych.Niemniej jednak w niektórych badaniach klinicznych zajęto się nocyceptywnym i przeciwbólowym działaniem PRP.Kilka badań wykazało, że pacjenci leczeni z powodu ścięgien lub uszkodzeń stożka rotatorów odczuwają niewielką ulgę w bólu.Natomiast kilka innych badań wykazało, że PRP może zmniejszyć lub nawet wyeliminować ból u pacjentów ze zwyrodnieniem ścięgien, chorobą zwyrodnieniową stawów, zapaleniem powięzi podeszwowej i innymi chorobami stóp i kostek.Ostateczne stężenie płytek krwi i biologiczny skład komórek zostały zidentyfikowane jako kluczowe cechy PRP, które pozwalają zaobserwować stały efekt przeciwbólowy po zastosowaniu PRP.Inne zmienne obejmują metodę dostarczania PRP, technologię aplikacji, protokół aktywacji płytek krwi, poziom aktywności biologicznej PGF i uwalnianych cytokin, rodzaj tkanki, w której zastosowano PRP oraz rodzaj uszkodzenia.
Warto zauważyć, że Kuffler odkrył potencjał PRP w łagodzeniu bólu u pacjentów z łagodnym do ciężkiego przewlekłym bólem neuropatycznym, wtórnym do uszkodzenia nerwu nieregenerującego.Celem tego badania jest zbadanie, czy ból neuropatyczny można zmniejszyć lub ustąpić dzięki PRP promującym regenerację aksonów i ponowne unerwienie nerwów docelowych.Co zaskakujące, wśród pacjentów poddawanych leczeniu ból neuropatyczny nadal jest eliminowany lub łagodzony co najmniej sześć lat po operacji.Ponadto wszyscy pacjenci zaczęli łagodzić ból w ciągu trzech tygodni po zastosowaniu PRP.
Ostatnio podobne działanie przeciwbólowe PRP zaobserwowano w dziedzinie pielęgnacji ran pooperacyjnych i skóry.Co ciekawe, autorzy opisali fizjologiczne aspekty bólu ran związanego z uszkodzeniem naczyń i niedotlenieniem tkanki skórnej.Omówili także znaczenie angiogenezy w optymalizacji natlenienia i dostarczania składników odżywczych.Ich badanie wykazało, że w porównaniu z grupą kontrolną pacjenci otrzymujący leczenie PRP odczuwali mniejszy ból i znacznie zwiększoną angiogenezę.Na koniec Johal i jego współpracownicy przeprowadzili przegląd systematyczny i metaanalizę, w wyniku których doszli do wniosku, że PRP może zmniejszyć ból po zastosowaniu PRP we wskazaniach ortopedycznych, zwłaszcza u pacjentów poddawanych leczeniu zewnętrznego zapalenia nadkłykcia i choroby zwyrodnieniowej stawu kolanowego.Niestety w badaniu tym nie określono wpływu białych krwinek, stężenia płytek krwi ani stosowania egzogennych aktywatorów płytek krwi, ponieważ zmienne te miałyby wpływ na ogólną skuteczność PRP.Nie jest jasne, jakie optymalne stężenie płytek PRP zapewniające maksymalne złagodzenie bólu jest niejasne.W szczurzym modelu tendinozy stężenie płytek krwi wyniosło 1,0 × 10 6 / μ. W L ból można całkowicie złagodzić, podczas gdy ulga w bólu spowodowana PRP o połowie stężenia płytek krwi jest znacznie zmniejszona.Dlatego zachęcamy do większej liczby badań klinicznych w celu sprawdzenia działania przeciwbólowego różnych preparatów PRP.
PRP i efekt angiogenezy
Preparaty C-PRP w precyzyjnej medycynie regeneracyjnej umożliwiają dostarczanie biomolekuł uwalnianych przez wysokie stężenia płytek krwi aktywowanych w docelowych miejscach tkanki.Dlatego zapoczątkowano różnorodne reakcje kaskadowe, które przyczyniają się do regulacji układu odpornościowego na miejscu, procesu zapalnego i angiogenezy, promując gojenie i naprawę tkanek.
Angiogeneza to dynamiczny, wieloetapowy proces obejmujący kiełkowanie i mikronaczynia tkankowe z wcześniej istniejących naczyń krwionośnych.Angiogeneza postępuje dzięki różnym mechanizmom biologicznym, w tym migracji, proliferacji, różnicowaniu i podziałowi komórek śródbłonka.Te procesy komórkowe są warunkiem wstępnym powstawania nowych naczyń krwionośnych.Są niezbędne do wzrostu istniejących naczyń krwionośnych, przywrócenia przepływu krwi i wspierania wysokiej aktywności metabolicznej związanej z naprawą i regeneracją tkanek.Te nowe naczynia krwionośne umożliwiają dostarczanie tlenu i składników odżywczych oraz usuwanie produktów ubocznych z leczonych tkanek.
Aktywność angiogenezy jest regulowana poprzez stymulację czynnika angiogennego VEGF i czynników antyangiogennych (np. angiostatyny i trombospondyny-1 [TSP-1]).W chorym i zdegradowanym mikrośrodowisku (m.in. niska prężność tlenu, niskie pH i wysoki poziom kwasu mlekowego) lokalne czynniki angiogenne przywrócą aktywność angiogenezy.
Kilka podłoży rozpuszczalnych w płytkach krwi, takich jak zasadowy FGF i TGF-β oraz VEGF, może stymulować komórki śródbłonka do wytwarzania nowych naczyń krwionośnych.Landsdown i Fortier podali różne wyniki dotyczące składu PRP, w tym wewnątrzpłytkowych źródeł wielu regulatorów angiogennych.Ponadto doszli do wniosku, że wzrost angiogenezy przyczynia się do gojenia się choroby MSK w obszarach o słabym unaczynieniu, takich jak uszkodzenie łąkotki, uszkodzenie ścięgna i innych obszarach o słabym unaczynieniu.
Promowanie i antyangiogenne właściwości płytek krwi
W ostatnich kilkudziesięciu latach opublikowane badania wykazały, że płytki krwi odgrywają kluczową rolę w pierwotnej hemostazie, tworzeniu skrzepów, uwalnianiu czynników wzrostu i cytokin oraz regulacji angiogenezy w ramach procesu naprawy tkanek.Paradoksalnie, granulki PRP α zawierają arsenał proangiogennych czynników wzrostu, białek antyangiogennych i cytokin (takich jak PF4, inhibitor aktywatora plazminogenu-1 i TSP-1) i ukierunkowane są na uwalnianie określonych czynników, które odgrywają rolę .Rola w angiogenezie.Dlatego też rolę PRP w kontrolowaniu regulacji angiogenezy można określić poprzez aktywację specyficznych receptorów na powierzchni komórki, TGF-β. Inicjuje reakcje proangiogenne i antyangiogenne.Zdolność płytek krwi do wykonywania szlaku angiogenezy została potwierdzona w angiogenezie patologicznej i angiogenezie nowotworowej.
Płytkowy angiogenny czynnik wzrostu i antyangiogenny czynnik wzrostu, pochodzące z cząsteczek α- i gęstych i adhezyjnych.Co najważniejsze, ogólnie przyjmuje się, że ogólny wpływ płytek krwi na angiogenezę jest proangiogenny i stymulujący.Oczekuje się, że terapia PRP będzie kontrolować indukcję angiogenezy, co przyczyni się do uzyskania efektu leczniczego wielu chorób, takich jak gojenie ran i naprawa tkanek.Podawanie PRP, a dokładniej podawanie PGF o wysokim stężeniu i innych cytokin płytkowych, może indukować angiogenezę, angiogenezę i arteriogenezę, ponieważ czynnik 1a pochodzący z komórek zrębowych wiąże się z receptorem CXCR4 na komórkach progenitorowych śródbłonka.Bill i in.Sugeruje się, że PRP wzmaga neowaskularyzację niedokrwienną, co może wynikać ze stymulacji angiogenezy, angiogenezy i arteriogenezy.W ich modelu in vitro proliferacja komórek śródbłonka i tworzenie naczyń włosowatych były indukowane przez dużą liczbę różnych PDG, z których VEGF był głównym stymulatorem angiogennym.Innym ważnym i istotnym czynnikiem przywracającym szlak angiogenezy jest synergia pomiędzy wieloma PGF.Richardsona i in.Wykazano, że synergiczne działanie czynnika angiogennego płytkopochodnego czynnika wzrostu bb (PDGF-BB) i VEGF prowadzi do szybkiego tworzenia dojrzałej sieci naczyniowej w porównaniu z działaniem pojedynczego czynnika wzrostu.Łączny wpływ tych czynników został niedawno potwierdzony w badaniu dotyczącym poprawy mózgowego krążenia obocznego u myszy z długotrwałą hipoperfuzją.
Co najważniejsze, w badaniu in vitro zmierzono proliferacyjny wpływ ludzkich komórek śródbłonka żyły pępowinowej i różnych stężeń płytek krwi na wybór urządzenia do przygotowania PRP i strategii dawkowania płytek krwi, a wyniki wykazały, że optymalna dawka płytek krwi wynosiła 1,5 × 10 6 płytek krwi/ μ 50. Promowanie angiogenezy.Zbyt duże stężenie płytek krwi może hamować proces angiogenezy, przez co efekt będzie słaby.
Starzenie się komórek, starzenie się i PRP
Starzenie się komórek może być wywołane różnymi bodźcami.Jest to proces, w którym komórki przestają się dzielić i przechodzą unikalne zmiany fenotypowe, aby zapobiec nieograniczonemu wzrostowi uszkodzonych komórek, co odgrywa ważną rolę w profilaktyce nowotworów.W procesie starzenia fizjologicznego, starzenie replikacyjne komórek będzie również sprzyjać starzeniu się komórek, a zdolność regeneracyjna MSC zostanie zmniejszona.
Skutki starzenia i starzenia się komórek
In vivo wiele typów komórek będzie się starzeć i gromadzić się w różnych tkankach podczas starzenia, wśród których znajduje się duża liczba starzejących się komórek.Wydaje się, że akumulacja starzejących się komórek wzrasta wraz z wiekiem, uszkodzeniem układu odpornościowego, uszkodzeniem tkanek lub czynnikami związanymi ze stresem.Mechanizm starzenia się komórek został zidentyfikowany jako czynnik chorobotwórczy chorób związanych z wiekiem, takich jak choroba zwyrodnieniowa stawów, osteoporoza i zwyrodnienie krążka międzykręgowego.Różnorodne bodźce pogłębiają starzenie się komórek.W odpowiedzi fenotyp wydzielniczy związany ze starzeniem się (SASP) będzie wydzielał wysokie stężenia komórek białkowych i cytokin.Ten szczególny fenotyp związany jest ze starzeniem się komórek, w których wydzielają wysoki poziom cytokin zapalnych (takich jak IL-1, IL-6, IL-8), czynników wzrostu (takich jak TGF-β, HGF, VEGF, PDGF), MMP i katepsyna.W porównaniu z młodymi ludźmi, wykazano, że SAPS zwiększa się wraz z wiekiem, ponieważ proces stacjonarny zostaje zniszczony, co powoduje starzenie się komórek i zmniejszoną zdolność regeneracji.W szczególności w chorobach stawów i chorobach mięśni szkieletowych.Pod tym względem starzenie immunologiczne uważa się za znaczącą zmianę w spektrum wydzielania komórek odpornościowych, wskazującą, że wzrasta stężenie TNF-a, IL-6 i/lub Il-1b, co prowadzi do przewlekłego stanu zapalnego o niskim stopniu nasilenia.Warto zauważyć, że dysfunkcja komórek macierzystych jest również powiązana z pozakomórkowymi mechanizmami autonomicznymi, takimi jak starzenie się komórek, zwłaszcza wytwarzanie przez SASP czynników prozapalnych i przeciwregeneracyjnych.
Wręcz przeciwnie, SASP może również stymulować plastyczność komórek i przeprogramowywanie sąsiadujących komórek.Ponadto SASP może organizować komunikację z różnymi mediatorami odpornościowymi i aktywować komórki odpornościowe, aby promować usuwanie starzejących się komórek.Zrozumienie roli i funkcji starzejących się komórek przyczyni się do gojenia i przebudowy tkanek mięśni MSK i ran przewlekłych.
Warto zauważyć, że Ritcka i in.Przeprowadzono szeroko zakrojone badania, w których odkryto główną i korzystną rolę SASP w promowaniu plastyczności komórek i regeneracji tkanek, a także wprowadzono koncepcję przejściowego leczenia starzejących się komórek.Ostrożnie wspomnieli, że starzenie się jest przede wszystkim procesem korzystnym i regeneracyjnym.
Starzenie się komórek i potencjał PRP
Wraz ze spadkiem liczby komórek macierzystych starzenie się będzie miało wpływ na wydajność komórek macierzystych.Podobnie u ludzi cechy komórek macierzystych (takie jak suchość, proliferacja i różnicowanie) również zmniejszają się wraz z wiekiem.Wang i Nirmala podali, że starzenie się zmniejsza cechy komórek macierzystych komórek ścięgien i liczbę receptorów czynników wzrostu.Badania na zwierzętach wykazały, że stężenie PDGF u młodych koni było wysokie.Doszli do wniosku, że wzrost liczby receptorów GF i liczby GF u młodych osób może powodować lepszą odpowiedź komórkową na leczenie PRP niż u starszych osób u młodych osób.Odkrycia te ujawniają, dlaczego leczenie PRP może być mniej skuteczne lub nawet nieskuteczne u starszych pacjentów z mniejszą liczbą komórek macierzystych i „złej jakości”.Udowodniono, że po podaniu PRP następuje odwrócenie procesu starzenia starzejącej się chrząstki i wydłużenie okresu spoczynku chondrocytów.Jia i in.Stosuje się go do badania fotostarzenia in vitro fibroblastów skóry myszy, z leczeniem PRP i bez niego, w celu wyjaśnienia mechanizmu przeciwdziałania PGF w tym modelu.W grupie PRP wykazano bezpośredni wpływ na macierz zewnątrzkomórkową, wzrost kolagenu typu I oraz zmniejszenie syntezy metaloproteinaz, co wskazuje, że PRP może przeciwdziałać starzeniu się komórek, a także w chorobie zwyrodnieniowej MSK.
W innym badaniu PRP wykorzystano do pobrania dojrzałych komórek macierzystych szpiku kostnego od starszych myszy.Stwierdzono, że PRP może przywracać różne funkcje komórek macierzystych powstałe w wyniku starzenia, takie jak proliferacja komórek i tworzenie kolonii, a także rekonstruować markery związane ze starzeniem się komórek.
Niedawno Oberlohr i jego współpracownicy szeroko badali rolę starzenia się komórek w osłabianiu regeneracji mięśni i oceniali PRP i osocze ubogie w płytki krwi (PPP) jako biologiczne możliwości leczenia naprawy mięśni szkieletowych.Przewidywali, że leczenie PRP lub PPP w celu naprawy mięśni szkieletowych będzie opierać się na czynnikach biologicznych dostosowanych do specyficznych markerów komórkowych SASP i innych czynników prowadzących do rozwoju zwłóknienia.
Rozsądnie jest wierzyć, że przed zastosowaniem PRP ukierunkowane starzenie się komórek może poprawić charakterystykę regeneracji i skuteczność leczenia biologicznego poprzez redukcję lokalnych czynników SASP.Sugerowano, że inną opcją poprawy wyników leczenia PRP i PPP w regeneracji mięśni szkieletowych jest selektywne usuwanie starzejących się komórek za pomocą starzejących się zmiataczy.Nie ulega wątpliwości, że najnowsze wyniki badań nad wpływem PRP na starzenie się i starzenie się komórek są fascynujące, jednak są one wciąż w początkowej fazie.Dlatego też przedstawianie jakichkolwiek sugestii w tym momencie jest nieuzasadnione.
(Treść tego artykułu została przedrukowana i nie udzielamy żadnej wyraźnej ani dorozumianej gwarancji co do dokładności, wiarygodności ani kompletności treści zawartych w tym artykule i nie ponosimy odpowiedzialności za opinie zawarte w tym artykule, prosimy o zrozumienie.)
Czas publikacji: 01 marca 2023 r